Palabras clave
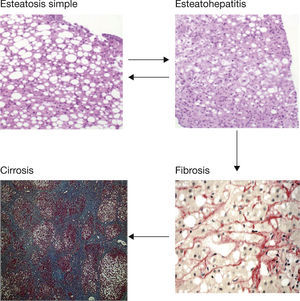
El hígado graso no alcohólico (HGNA) se caracteriza por la acumulación de ácidos grasos libres y triglicéridos en el citoplasma de los hepatocitos, preferentemente en forma de grandes vacuolas de grasa, en pacientes sin un consumo tóxico de alcohol (≤3 unidades de bebida estándar [UBE] al día en hombres y ≤2 UBE al día en mujeres) y no asociado a otras enfermedades hepáticas1. El HGNA incluye un amplio espectro de lesiones que van desde la esteatosis simple, generalmente con un pronóstico benigno, pasando por la esteatohepatitis con cambios inflamatorios y un grado variable de fibrosis, hasta la cirrosis y el carcinoma hepatocelular2 (fig. 1). El HGNA se asocia a los diferentes componentes del síndrome metabólico (SM), especialmente obesidad, diabetes tipo 2 (DM2) y resistencia a la insulina, de manera que es considerado por muchos autores como el componente hepático del SM. La prevalencia del HGNA en la población occidental oscila entre el 20% y el 30%, y puede ser superior al 70% entre los sujetos obesos o con DM2, mientras que la prevalencia estimada de esteatohepatitis (EHNA) es del 2-3%3,4. La prevalencia de esta enfermedad va en aumento en paralelo con el incremento de la obesidad y de la diabetes, verdaderas epidemias del siglo xxi5.
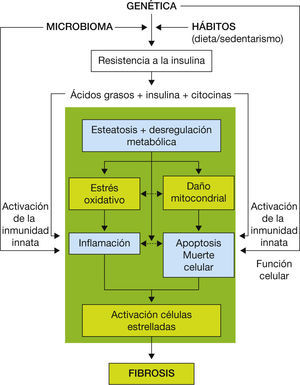
La patogenia de la enfermedad es compleja y no del todo conocida. En ella intervienen numerosos factores metabólicos, genéticos, ambientales y de la microbiota intestinal6,7. Aunque la presencia de esteatosis es un requisito imprescindible para la presencia de EHNA, los mecanismos por los cuales algunos pacientes desarrollan esteatohepatitis y otros presentan esteatosis simple no se conocen con exactitud. El tejido adiposo visceral genera múltiples señales que alteran el metabolismo de los lípidos y la glucosa, lo que conduce a la acumulación de grasa hepática y crea un medio proinflamatorio que desencadena lesiones celulares en el hígado y otros tejidos. La incapacidad para sofocar los procesos dañinos, como el estrés oxidativo, el estrés del retículo endoplásmico, la lipotoxicidad y las vías apoptóticas, contribuyen al daño hepático y a la fibrosis progresiva8 (fig. 2).
Los pacientes con HGNA suelen estar asintomáticos, y el papel de los médicos de atención primaria es fundamental en el diagnóstico, al menos de sospecha, y en el abordaje inicial9,10. En la actualidad, no se da la importancia debida a esta enfermedad, que se considera un proceso banal y posiblemente está infradiagnosticada11. Por otro lado, las guías clínicas recientes no son suficientemente conocidas o seguidas12,13.
Ya hemos comentado que se trata de una enfermedad asintomática y la sospecha diagnóstica se establece por la detección de un aumento moderado de las transaminasas cuando se practica una analítica por cualquier motivo, incluso en el curso de un examen de salud rutinario, o bien ante la presencia de signos de esteatosis en la ecografía abdominal, cuando esta se solicita para estudio de molestias abdominales inespecíficas, o por presentar alteración de la analítica. Desde el punto de vista clínico, la enfermedad se puede mani- festar como astenia, debilidad y, ocasionalmente, los pacientes pueden referir molestias y/o dolor en el hipocondrio derecho. La exploración física puede ser normal o bien detectar una hepatomegalia blanda e indolora, y en los pacientes con fibrosis avanzada y cirrosis, signos de hipertensión portal14. En la analítica, la elevación de las transaminasas suele ser moderada (inferior a 3 veces el valor normal), siendo la alanina-aminotransferasa (ALT) superior a la aspartato-aminotransferasa (AST)15, y pueden cursar con una colestasis discreta, especialmente la γ-glutamiltransferasa (GGT)16 y las fosfatasas alcalinas. Entre un 21% y un 40% de los pacientes presentan un aumento moderado de la ferritina y del índice de saturación de la transferrina sin que se haya demostrado un aumento paralelo de la concentración intrahepática de hierro17.
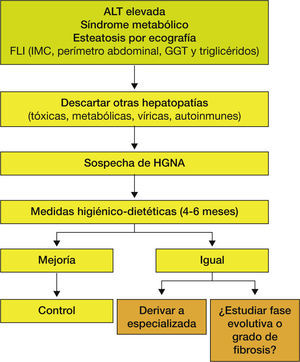
Así, ante la sospecha de un paciente con HGNA, lo primero que deberemos hacer es descartar la presencia de otras hepatopatías, especialmente: el consumo excesivo de alcohol; hepatopatías tóxicas, ya sea por consumo de medicamentos o de hierbas; víricas, hepatopatía crónica por virus B (HBsAg) o por virus C (anti-VHC); metabólicas, tales como hemocromatosis (hierro e índice de saturación de la transferrina), enfermedad de Wilson (cupruria y ceruloplasmina) y déficit de alfa-1-antitripsina; autoinmunes (anticuerpos antinucleares, antimúsculo liso, anti-LKM, antirriñón e hígado) o cirrosis biliar primaria (anticuerpos antimitocondriales). Además, deberemos investigar la presencia de componentes del SM, tales como sobrepeso u obesidad, DM2, dislipemia e hipertensión arterial. En caso de descartar la presencia de otras hepatopatías estaremos ante un paciente con un probable HGNA. En estos casos, lo más adecuado es adoptar una serie de medidas higiénico-dietéticas durante 4 a 6 meses y ver cómo evoluciona la analítica. Una revisión sistemática basada en los resultados de 23 estudios demuestra que la dieta y el ejercicio físico se acompañaron de una disminución de la grasa hepática y una mejoría del control de la glucosa y de la resistencia a la insulina18. De manera que, si el paciente mejora, haremos controles periódicos, y en caso de continuar igual se debería estudiar la presencia de inflamación, fibrosis y en función de la gravedad de esta, plantear si se tiene que hacer un seguimiento especializado (fig. 3).
Un aspecto controvertido es si la existencia de HGNA debería buscarse sistemáticamente en todos los sujetos con factores de riesgo, si bien algunas guías clínicas no lo recomiendan12, teniendo en cuenta la relación coste-beneficio a largo plazo12. Por otra parte, en general, cuando el diagnóstico de HGNA se establece por la existencia de alteraciones analíticas en pacientes con uno o más componentes del SM, se solicita una ecografía abdominal, medida que constituye otro motivo de controversia19. Sin embargo, a pesar de tener sus argumentos, nosotros pensamos que es necesario descartar la enfermedad, incidir sobre los factores de riesgo y seguir la evolución tanto clínica como analítica con las exploraciones disponibles en el momento actual.
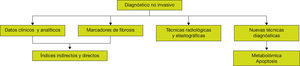
Así, ante un paciente con probable HGNA deberíamos confirmar el diagnóstico, y ante la presencia o persistencia de alteración de las transaminasas deberíamos valorar la presencia de EHNA, si bien algunos pacientes pueden cursar con valores normales de las transaminasas, y por último descartar la presencia y gravedad de fibrosis hepática. Ello lo podemos hacer mediante los denominados métodos no invasivos e invasivos. A continuación, describiremos los diferentes métodos.
Métodos invasivosBiopsia hepáticaEs el método invasivo por excelencia, constituye el método de elección para hacer el diagnóstico de HGNA y es el único capaz de distinguir entre el hígado graso simple y la EHNA. Además, permite clasificar la enfermedad de acuerdo al grado de actividad (grado de inflamación y daño celular) y la intensidad de la fibrosis, lo que permitirá establecer el pronóstico12.
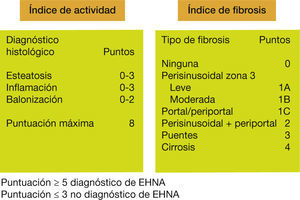
Para unificar criterios, un grupo de expertos establecieron un índice de actividad (NAS score)20 que incluye la esteatosis (0-3), la inflamación lobular (0-3) y la degeneración hidrópica celular (0-2), de manera que un índice ≥ 5 permite el diagnóstico de certeza de EHNA, mientras que un índice ≤ 3 lo excluye. Dado que la fibrosis es la lesión que más con- diciona el pronóstico, también se ha establecido una gradación en cuatro estadios de fibrosis: 1) pericelular, 2) portal, 3) con puentes y 4) cirrosis (fig. 4). Sin embargo, la biopsia hepática no está disponible en todos los niveles asistenciales y presenta una serie de limitaciones, tales como error de muestra, tamaño de la biopsia, la variabilidad en la interpretación por parte del patólogo, el coste y, aunque baja, la morbilidad inherente a todo procedimiento invasivo.
Métodos no invasivosLos métodos no invasivos consisten en diferentes marcadores serológicos, pruebas de imagen y elastográficas, que pretenden diagnosticar y cuantificar el HGNA, así como poder predecir la existencia de EHNA o fibrosis avanzada21. Además del diagnóstico y la cuantificación de la grasa, también son de utilidad para predecir en un futuro la DM2 y otros factores de riesgo cardiovascular22,23. Los marcadores no invasivos deben tener como objetivo: a) identificar el riesgo de HGNA en individuos con trastornos metabólicos; b) identificar aquellos con peor pronóstico, tales como EHNA grave; c) controlar la progresión de la enfermedad, y d) predecir la respuesta a las intervenciones terapéuticas. El logro de estos objetivos podría reducir la necesidad de biopsia hepática24. Un buen marcador debe ser fácil de realizar, tener un bajo coste y una sensibilidad y especificidad apropiadas, y la mejor manera de evaluar el test es el análisis de las curvas ROC y el área bajo la curva (AUROC), que evalúa la probabilidad de encontrar un resultado positivo verdadero frente a un resultado positivo falso. Cuando el AUROC es superior a 0,80 se considera que tiene una buena precisión (fig. 5).
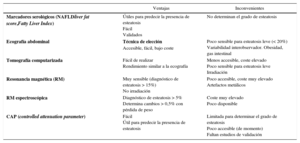
Hígado graso no alcohólicoMarcadores serológicosLa presencia de factores de riesgo coexistentes como diabetes, SM u obesidad con elevación de las transaminasas (sobre todo la ALT) aumenta las posibilidades de presentar HGNA. No obstante, aunque la ALT es un test útil, no es válido para predecir la presencia de HGNA dado que puede cursar con ALT normal25. La combinación de marcadores serológicos y alguna técnica de imagen mejora el rendimiento diagnóstico (tabla 1).
Marcadores serológicos y pruebas de imagen de hígado graso no alcohólico
| Ventajas | Inconvenientes | |
|---|---|---|
| Marcadores serológicos (NAFLDliver fat score,Fatty Liver Index) | Útiles para predecir la presencia de esteatosis Fácil Validados | No determinan el grado de esteatosis |
| Ecografía abdominal | Técnica de elección Accesible, fácil, bajo coste | Poco sensible para esteatosis leve (< 20%) Variabilidad interobservador. Obesidad, gas intestinal |
| Tomografía computarizada | Fácil de realizar Rendimiento similar a la ecografía | Menos accesible, coste elevado Poco sensible para esteatosis leve Irradiación |
| Resonancia magnética (RM) | Muy sensible (diagnóstico de esteatosis > 15%) No irradiación | Poco accesible, coste muy elevado Artefactos metálicos |
| RM espectroscópica | Diagnóstico de esteatosis > 5% Determina cambios > 0,5% con pérdida de peso | Coste muy elevado Poco disponible |
| CAP (controlled attenuation parameter) | Fácil Útil para predecir la presencia de esteatosis | Limitada para determinar el grado de esteatosis Poco accesible (de momento) Faltan estudios de validación |
Existen diversos índices serológicos, tales como el Fatty Liver Index (FLI), el Steatotest® y el NAFLD liver fat score, que predicen con fiabilidad la presencia de esteatosis, si bien no son útiles para predecir el grado de fibrosis26. De todos ello, el más conocido y utilizado en nuestro entorno es el FLI. Fue descrito por Bedogni en el 200627 y combina los valores de triglicéridos, la GGT, el perímetro abdominal y el índice de masa corporal (IMC). El grupo PREDAPS, grupo español, que está siguiendo una cohorte de prediabéticos, ha podido demostrar cómo la presencia de FLI como marcador de esteatosis hepática tenían un riesgo hasta 6 veces superior de desarrollar una DM2 a los 3 años de seguimiento. Estos resultados concuerdan con los de estudios previos28,29. Un estudio poblacional europeo sobre la capacidad del FLI para el diagnóstico de HGNA en una población de 2652 sujetos mayores encontró que el FLI demostró una excelente fiabilidad para identificar pacientes con HGNA, confirmada posteriormente mediante ecografía abdominal30.
Pruebas de imagenLas pruebas de imagen convencionales (ecografía, tomografía computarizada [TC] y resonancia magnética [RM]) son de utilidad para visualizar los cambios en la morfología hepática secundarios a la acumulación de grasa en el hígado y permiten evidenciar con alta especificidad los cambios relacionados con cirrosis en caso de EHNA en evolución cirrótica. Por otro lado, ninguna de ellas permite diferenciar entre esteatosis simple y EHNA, así como distinguir el grado de fibrosis (tabla 1).
Ecografía abdominalEs la prueba de imagen de primer nivel y la que debemos de solicitar siempre en caso de sospecha diagnóstica de HGNA debido a su bajo coste, seguridad, accesibilidad y posibilidad de repetición. Los signos diagnósticos de esteatosis incluyen: a) aspecto hiperecogénico (brillante) del hígado, que resulta más evidente en comparación con el aspecto del parénquima renal o esplénico; b) atenuación de la transmisión de los ultrasonidos a los segmentos posteriores del hígado y c) disminución de visualización de las paredes del árbol vascular intrahepático y de la vesícula biliar. El rendimiento de la ecografía para diagnosticar esteatosis varía considerablemente entre estudios (sensibilidad: 60-94%; especificidad: 66-95%)31–33, principalmente a causa de su baja sensibilidad para diagnosticar esteatosis leve (<20% de los hepatocitos)34.
Tomografía computarizadaPermite diagnosticar esteatosis hepática sin emplear medio de contraste. La TC tiene un buen rendimiento para diagnosticar esteatosis > 30% (sensibilidad 73-100% y especificidad 95-100%), y es similar al de la ecografía abdominal35.
Resonancia magnéticaNo utiliza radiación ionizante y tiene pocas contraindicaciones. El estudio, que en la actualidad es muy rápido y no requiere administración de contraste, permite diagnosticar esteatosis superiores al 15% con alta fiabilidad36. Sin embar- go, la técnica es subóptima para diagnosticar esteatosis inferiores al 15%.
Resonancia magnética espectroscópicaEsta técnica es la más exacta disponible hasta la fecha para cuantificar de forma no invasiva la esteatosis hepática. La cuantificación de la esteatosis obtenida por esta técnica se correlaciona estrechamente con la esteatosis histológica y puede diagnosticar niveles de contenido hepático en triglicéridos superiores al 5%; además, es fiable para determinar los cambios (≥0,5%) en el grado de esteatosis después de la disminución del peso37.
Controlled attenuation parameterEs una nueva aplicación de la elastografía hepática disponible en los aparatos de última generación, que permite estimar de forma inmediata y no invasiva la esteatosis; la medición es contemporánea a la de rigidez hepática y, por tanto, sufre de las mismas limitaciones. El controlled attenuation parameter (CAP) mide al grado de atenuación (expresado en dB/m y variable entre 100 y 400dB/m) de la onda de ultrasonidos transmitida a través del hígado a la frecuencia central del transductor habitual (M probe, 3,5MHz), que es proporcional a la cantidad de grasa hepática38. Los datos publicados hasta la fecha indican que el CAP es capaz de diagnosticar esteatosis incluso en estadios leves (>11%), y que puede discriminar entre esteatosis leve y grave, ya que tiene una correlación muy buena con el grado de esteatosis (r = 0,81)39.
Esteatohepatitis no alcohólicaMarcadoresLa diferenciación entre HGNA y EHNA tiene implicaciones pronósticas y no se pueden diferenciar mediante los signos clínicos y los síntomas, por lo que el diagnóstico debe realizarse mediante la práctica de la biopsia hepática. Para evitar la biopsia, se han evaluado numerosos marcadores séricos para predecir la existencia de EHNA, como marcadores inflamatorios que incluyen la proteína C reactiva, interleucina 6, ácido hialurónico, TNF-α, o marcadores de estrés oxidativo, como lipoproteína de baja densidad oxidizada, entre otros. Sin embargo, tanto unos como otros han sido evaluados en series cortas o estudios pilotos y con resultados contradictorios por lo que, de momento, no son recomendables en la práctica clínica diaria12,13.
Es bien conocido que la apoptosis desempeña un papel fundamental en la patogenia de la EHNA. Entre los diferentes marcadores de apoptosis, la citoqueratina 18 (CK-18) es uno de los biomarcadores más prometedores en la detección no invasiva de la EHNA. Los niveles plasmáticos de la CK-18 están significativamente aumentados en pacientes con EHNA en comparación con pacientes con HGNA40. Estas observaciones se han podido reproducir en otros estudios, y en un reciente metaanálisis se ha observado que los niveles plasmáticos de CK-18 tienen una sensibilidad del 78%, una especificidad del 86% y un AUROC de 0,82 para identificar EHNA en pacientes con HGNA41. No obstante, este marcador no está comercializado.
Recientemente, un grupo español ha desarrollado un test sanguíneo no invasivo basado en la metabolómica que permite evaluar la progresión del HGNA, el OWL Liver Test42. Los autores estudiaron el perfil metabólico de 467 pacientes con biopsia hepática (90 normal, 246 con HGNA y 131 con EHNA) y observaron que el perfil metabólico dependía del IMC, lo que pone de manifiesto que el mecanismo patogénico del HGNA podía ser diferente según el nivel individual del grado de obesidad, y que permitía diferenciar entre EHNA y HGNA. Mediante un modelo multivariante pudieron separar a los pacientes con y sin EHNA, con una buena especificidad y sensibilidad. El test ya está validado y comercializado.
FibrosisMarcadores serológicosLos test más validados son el Enhanced Liver Fibrosis (ELF score), el NAFLD Fibrosis Score (NFS) y el FIB-4 (tabla 2).
Marcadores serológicos de fibrosis
| NAFLD Fibrosis Score (NFS) = [-1,675 + 0,037 × edad (años) + 0,094 × IMC (kg/m) + 1,13 × IFG/diabetes (sí = 1, no = 0) + 0,99 × cociente AST/ALT -0,013 × plaquetas (×109/l) – 0,66 × albúmina (g/dl)] | NFS < -1,455: excluye fibrosis avanzada NFS entre 1,455-0,676 indeterminado NFS > 0,676: identifica fibrosis avanzada |
| FIB-4 = [edad (años) × AST (U/I)/(plaquetas (×109/l) × (ALT (U/I)1/2] | FIB-4 < 1,30 excluye fibrosis avanzada FIB-4 entre <1,30 y >2,67 indeterminado FIB-4 > 2,67 identifica fibrosis avanzada |
| Enhanced Liver Fibrosis (ELF) = 2,278 + 0,851 ln (CAH(ácidohialurónico)) + 0,751 ln (CPlIINP(péptidoaminoterminalprocolágenotipoII)) + 0,394 ln (CTIMP1(inhibidordelasmetaloproteinasasTIMP1)) | ELF entre 6,6 y 7,4: fibrosis leve ELF entre 7,4 y 10,5: fibrosis leve-moderada ELF entre 10,5 y 12: fibrosis moderada-grave ELF superior a 12: cirrosis |
El ELF score se evaluó en más de 1000 pacientes, entre ellos 61 con HGNA, combinando la edad y la determinación de los niveles de tres proteínas del recambio de la matriz celular (ácido hialurónico, TIMP-1 y P3NP). El AUROC para fibrosis avanzada fue de 0,87, y aumentó a 0,9 cuando el mismo sistema de puntuación, excluyendo la edad, se aplicó a 196 pacientes43. La limitación de este estudio es la cohorte relativamente pequeña estudiada de pacientes con HGNA. Recientemente, nuestro grupo ha llevado a cabo un estudio sobre identificación de fibrosis en pacientes con elevación de las enzimas hepáticas mediante métodos diagnósticos no invasivos, que ha mostrado una buena relación con el grado de fibrosis determinado por elastografía hepática y una correlación significativa en los pacientes con fibrosis moderada o grave. El valor diagnóstico de ELF en la predicción de fibrosis fue aceptable en los pacientes con fibrosis moderada (AUROC = 0,70), pero inferior a NFS y mejor en los sujetos con fibrosis grave (AUROC = 0,93)44. Sin embargo, el principal problema de la utilización de dicho test radica en que la determinación de sus componentes no está disponible en la mayoría de los centros de salud.
El NFS es el sistema de puntuación más estudiado45. El índice incluye seis variables fáciles de obtener (edad, IMC, glucemia, recuento de plaquetas, albúmina y la relación AST/ALT) y se calcula utilizando la fórmula publicada (http://nafldscore.com). En un metaanálisis de 13 estudios que incluían 3064 pacientes, el NFS presentó un AUROC = 0,85 en la predicción de fibrosis avanzada (fibrosis en puentes o cirrosis), de modo que una puntuación inferior a −1,455 tuvo una sensibilidad del 90% y una especificidad del 60% para excluir fibrosis avanzada, mientras que una puntuación superior a 0,676 tuvo una sensibilidad del 67% y una especificidad del 97% para identificar la presencia de fibrosis avanzada41. En otro estudio, el NFS discriminó bien a los pacientes con HGNA según el grado de fibrosis (leve, moderada o grave) en la predicción de complicaciones relacionadas con la enfermedad hepática, así como con la probabilidad de trasplante o fallecimiento46.
El FIB-4 está constituido por las plaquetas, ALT, AST y la edad. Inicialmente, se propuso para el estudio del grado de fibrosis en los pacientes con virus de la hepatitis C (VHC)47. El FIB-4 diagnostica correctamente los pacientes con fibrosis grave y cirrosis con un valor AUROC = 0,85 (intervalo de confianza [IC] al 95%: 0,82-0,89) y 0,91 (IC al 95%: 0,86-0,93) respectivamente. Recientemente, se ha llevado a cabo un estudio en nuestro país para validar los índices FIB-4 y NFS para discriminar fibrosis en pacientes con HGNA. Se incluyeron 1214 pacientes todos ellos biopsiados. Los coeficientes de correlación entre NFS y FIB-4 respecto a la fibrosis avanzada fueron 0,28 (p < 0,01) y 0,38 (p < 0,01), respectivamente. El FIB-4 alcanzó un AUROC mayor para la predicción de fibrosis avanzada (0,78; IC95%: 0,74-0,82) que el NFS (0,73; IC95%: 0,69-0,76); p = 0,04. De ellos, el 39,4% (478/1214) y el 21,6% (262/1214) de los pacientes fueron clasificados como indeterminados para NFS y FIB-4, respectivamente (p < 0,01). Para la predicción de fibrosis avanzada, el valor predictivo negativo (VPN) fue del 91% (964/1055) y el valor predic- tivo positivo (VPP) del 32% (51/159) utilizando un punto de corte en NFS > 0,67. Aplicando en FIB-4 un punto de corte mayor de 2,67, el VPN obtenido fue del 90,3% (1053/1166) y el VPP del 60% (29/48). Finalmente, para excluir fibrosis, un punto de corte inferior a –1,45 para NFS alcanzó un VPP del 95% (550/577), y empleando el umbral en FIB-4 inferior a –1,30, el VPP alcanzado fue 95% (859/904)48.
Métodos elastográficosLos métodos elastográficos permiten cuantificar la rigidez de los tejidos, cuyo componente principal en el hígado es la fibrosis (tabla 3).
Métodos elastográficos
| Ventajas | Inconvenientes | |
|---|---|---|
| Elastografía hepática (Fibroscan®) | Fácil, rápida Buen rendimiento para el diagnóstico de fibrosis grave y cirrosis (AUROC > 0,90) | Rendimiento inferior para fibrosis moderada Falsos positivos Limitada con IMC > 30 (sonda XL) |
| ARFI (acoustic radiation forcé impulse imaging) | Incorpora un ecógrafo Rendimiento diagnóstico de fibrosis avanzada y cirrosis similar a elastografía (AUROC 0,90). Aplicabilidad en pacientes obesos superior a elastografía hepática | Falta de estandarización de la técnica con valores de puntos de corte reducidos para fibrosis avanzada y cirrosis, que puede inducir a error diagnóstico Experiencia limitada |
| Elasto RM (elastografía por resonancia magnética) | Excelente rendimiento diagnóstico de fibrosis en pacientes con HGNA/EHNA AUROC fibrosis leve-moderada 0,99 AUROC fibrosis grave o cirrosis 1,00 Aplicabilidad en obesos | Falta de estandarización de la técnica Experiencia limitada Poca disponibilidad |
AUROC: área bajo la curva ROC; EHNA: esteatohepatitis no alcohólica; HGNA: hígado graso no alcohólico; IMC: índice de masa corporal.
La elastografía hepática (FibroScan®, Echosens, Francia) mide por ultrasonidos la velocidad de propagación de una onda mecánica expresada en kilopascales (kPa). A mayor velocidad de propagación, mayor rigidez del tejido. A nivel hepático, la velocidad de propagación del área explorada (1cm de diámetro y 2-4cm de longitud) se relaciona con el grado de fibrosis presente en el parénquima49.
En pacientes con HGNA/EHNA, la elastografía hepática tiene una aplicabilidad menor que en otras hepatopatías debido a la elevada prevalencia de obesidad en esta población: se han notificado fallos en el 10-16% de los sujetos, en gran parte debido a la atenuación de la onda elástica por parte de la grasa subcutánea en pacientes con un IMC > 3050. Los resultados procedentes de los estudios con la sonda XL, que permite una mayor penetración de la onda, muestran una mejora del rendimiento diagnóstico y per- mitirá poder hacer la elastografía hepática en estos en- fermos51. El rendimiento diagnóstico para diagnosticar fibrosis significativa (definida como fibrosis al menos perisinusoidal y portal/periportal) es inferior a la comunicada en pacientes con hepatopatía por otras etiologías (AUROC = 0,84-0,88). En cambio, el rendimiento es bueno para diagnosticar fibrosis avanzada (AUROC = 0,91-0,93), y óptimo para diagnosticar cirrosis (AUROC = 0,95-0,99)41. Los valores de corte aceptados, según los resultados de varios estudios, en pacientes con HGNA son 7,0kPa para fibrosis significativa, 8,7kPa para fibrosis avanzada y 10,3kPa para cirrosis50,52–54. Los valores de corte para evaluar la fibrosis son inferiores a los de los enfermos con infección crónica por VHC55,56. Recientemente se han presentado los resultados de un estudio sobre la detección precoz de hepatopatía crónica silente en población general mediante la práctica de una elastografía hepática. El estudio ha incluido un total de 3076 sujetos adultos de edades comprendidas entre 18 y 75 años procedentes de 18 equipos de atención primaria, y se definieron tres puntos de corte de la elastografía. Estos fueron: 6,8kPa, 7,6kPa y 8,0kPa. La media de la elastografía hepática fue de 5,0 ± 2,2kPa (rango 2,0-46,4kPa). Según los puntos de corte predefinidos, un 9,0%, 6,8% y un 5,8% de los sujetos tenían una elastografía hepática superior a 6,8kPa, 7,6kPa y 8,0kPa, respectivamente. Se quiso conocer cuál era el mejor punto de corte para definir la presencia de fibrosis, y este fue de 9,2kPa con una sensibilidad del 93% y una especificidad del 78% con un valor bajo la curva AUROC de 0,87. Los componentes del SM fueron factores predictivos independientes del aumento de la rigidez hepática57.
Acoustic radiation force impulse imaging (ARFI)Este método de sonoelastografía se implementa en un equipo ecográfico tradicional y permite posicionar la zona de interés bajo control visual58. Su aplicabilidad en pacientes obesos es superior al de la elastografía hepática; en los estudios disponibles hasta hoy su fiabilidad para diagnosticar fibrosis avanzada o cirrosis en pacientes con HGNA parece similar al de la elastografía hepática (AUROC = 0,90)59.
Elastografía por resonancia magnéticaEs un nuevo método capaz de estudiar las propiedades elásticas en una región de interés del parénquima hepático. Por medio de una secuencia específica, esta técnica permite medir la propagación de las ondas mecánicas que se visualizan en forma de un elastograma cuantitativo (expresado en kPa). La fiabilidad de esta técnica para diagnosticar fibrosis hepática avanzada es superior al 85% y próxima al 100% para descartar la existencia de fibrosis. En un estudio llevado a cabo en 58 pacientes con HGNA, la rigidez hepática fue significativamente diferente en pacientes con HGNA, EHNA sin fibrosis y EHNA con fibrosis, y la técnica tuvo una óptima capacidad para discriminar entre HGNA y EHNA con fibrosis (AUROC = 0,93)60.
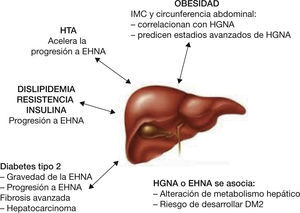
Trastornos metabólicos asociados a hígado graso no alcohólicoEl aumento de la obesidad y el sobrepeso y de la DM2, que afecta al 30% y al 8% de la población, respectivamente, hace previsible que la prevalencia de HGNA también vaya en aumento. A parte del mayor riesgo de los pacientes con DM2 a presentar un HGNA, existen evidencias que demuestran que el HGNA puede ser un factor de riesgo para el desarrollo de DM2. En este sentido, un estudio que comparaba sujetos con HGNA y controles, ambos sin diabetes, mostró una mayor prevalencia de DM2 y SM en los sujetos con HGNA cuando fueron reevaluados al cabo de 11 años61. Por otra parte, cuando se manifiesta una diabetes en sujetos con resistencia a la insulina y obesidad, la diabetes es un factor independiente de progresión del HGNA y de desarrollo de cirrosis62. Por tanto, cuando se estudia la asociación entre DM2 e HGNA no solo hay que considerar la prevalencia de HGNA, sino también la influencia de la diabetes en la progresión a esteatohepatitis. Podría decirse que existe un círculo vicioso entre hígado graso y diabetes63. Inicialmente, la resistencia a la insulina daría lugar a hígado graso y DM2 en los sujetos predispuestos, y la diabetes a su vez favorecería la progresión de la fibrosis y eventualmente el desarrollo de cirrosis y carcinoma hepatocelular.
En la actualidad existe cierta controversia sobre si se debe o no descartar la presencia de HGNA en todos los pacientes con diabetes, especialmente en aquellos que presentan diversos componentes del SM. En todo caso, la recomendación de descartar la presencia de HGNA se debería efectuar en aquellos pacientes con diabetes que presenten una elevación de las transaminasas o algún otro signo sugestivo de enfermedad hepática. Ello es debido, al menos en parte, a que los métodos de diagnóstico no invasivo no están bien establecidos y a que no existe un tratamiento eficaz. Dado que en muchos casos los pacientes con HGNA están estables y no evolucionan a esteatohepatitis, algunos autores también cuestionan el coste-beneficio de descartar el HGNA de manera rutinaria. Sin embargo, como se ha comentado en los apartados anteriores, la prevalencia de HGNA es muy elevada en los pacientes con DM2, y además ambos procesos se potencian mutuamente, de manera que los pacientes con HGNA, especialmente los obesos, están más predispuestos a desarrollar una DM2, y la DM2 favorece la progresión de las lesiones en el hígado graso. Por otra parte, tanto el HGNA como la DM2 predisponen al desarrollo de complicaciones cardiovasculares24,64.
Efectivamente, los pacientes con HGNA presentan un incremento del riesgo cardiovascular, no únicamente porque comparten factores de riesgo, sino porque al parecer, el HGNA per se favorece la aparición de episodios cardiovasculares adversos, lo que impacta en la morbimortalidad de estos pacientes65,66. Por tanto, es importante que una vez identificados estos pacientes, desde la atención primaria se realice alguna exploración destinada a detectar una arterioesclerosis subclínica67. Para ello pueden realizarse pruebas indirectas, relativamente sencillas y no invasivas, como un electrocardiograma y el índice tobillo-brazo. Sería también interesante implementar en los centros la ecografía de la pared de la carótida para medir tanto el grosor de la capa íntima-media como poder calcular el número de placas de ateroma. El rendimiento de dichas exploraciones es muy importante, con un grado de evidencia muy elevado65,67. Por otro lado, aunque no es motivo de dicha revisión, los pacientes deben ser tratados de manera intensiva de los trastornos metabólicos asociados al HGNA (obesidad, diabetes, dislipemia).
Actitud y seguimiento ante un paciente con HGNAUno de los aspectos más importantes es detectar los factores de riesgo de la enfermedad y a quién se debe de realizar el cribado. Además, ya se ha comentado que los factores de riesgo están estrechamente relacionados con los diferentes componentes del SM, de manera que el HGNA es el componente hepático del SM. En la figura 6 se muestra la correlación entre el SM y el HGNA. Por otro lado, en la tabla 4 mostramos a qué sujetos se debería realizar el cribado para conocer o no la presencia de la enfermedad, según las recomendaciones de la Guía Europea24.
¿A quién realizar el cribado?
| 1. Enfermos con resistencia a la insulina o factores de riesgo para síndorme metabólico: • Buscar datos de esteatosis (ecografía y transaminasas) |
| 2. Enfermos con esteatosis según las pruebas de imagen: • Buscar datos de síndrome metabólico |
| 3. Enfermos con hígado graso no alcohólico: • Descartar diabetes mellitus 2 • Descartar enfermedad cardiovascular |
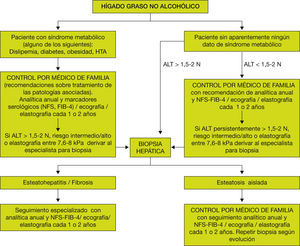
Una vez se han detectado los factores de riesgo y realizado el cribado de la enfermedad, deberemos tomar decisiones de cómo actuar ante un paciente con HGNA. Ello es importante, ya que permitirá decidir qué pacientes deben ser derivados a la medicina especializada y qué pacientes deberemos seguir controlando en nuestras consultas. En la figura 7 se muestra un algoritmo de actuación basado en las recomendaciones tanto del Documento de Posicionamiento de la Sociedad Catalana de Digestología13 como de la Guía Europea24. A pesar de todo, a veces es difícil el manejo desde las consultas de atención primaria. Para ello, debemos realizar controles analíticos cada año y ecografía cada 1 o 2 años. Sería conveniente, ante un paciente con alteración de las transaminasas de forma persistente, calcular algún índice serológico de fibrosis de fácil realización, preferentemente el NFS y si no el FIB-4. En caso de disponer en la actualidad o en un futuro de un Fibroscan®, se debería realizar una elastografía cada 1 o 2 años. Un aspecto importante es que no existe un límite de edad para el estudio y seguimiento de estos pacientes, si bien se desaconsejaría realizar según qué exploraciones a pacientes con una edad superior a los 75 años.
A pesar de los esfuerzos dedicados a entender y manejar la enfermedad, es evidente que todavía quedan muchos aspectos por dilucidar, en especial en relación con el diagnóstico no invasivo de la enfermedad, la evolución de esta, el manejo terapéutico y el seguimiento y control de estos pacientes.
En conclusión, los médicos de atención primaria deben tener un papel esencial en el diagnóstico y control de los pacientes con HGNA. Para ello es necesario mejorar la formación para concienciarlos sobre la magnitud del problema y dotar a los centros de algunos métodos diagnósticos no invasivos (serológicos y elastográficos) para poder conocer el grado evolutivo de la enfermedad y derivarlos cuando sea necesario. Además, es muy importante el control estricto de los factores asociados, en especial la diabetes y la obesidad, así como detectar y controlar las posibles enfermedades cardiovasculares.