- •
Los i-SGLT2 se expresan en el túbulo proximal y promueven la excreción renal de glucosa, reduciendo modestamente los niveles elevados de glucosa en sangre en personas con DM2.
- •
Los i-SGLT2 disminuyen el peso (2-3kg), la presión arterial, la HbA1c entre un 0,6% y un 0,9% y no causan hipoglucemia.
- •
Los i-SGLT2 son el tratamiento de elección tras la metformina en las personas con DM2 que han sufrido un evento aterosclerótico, insuficiencia cardíaca o enfermedad renal crónica.
- •
Se debe considerar los i-SGLT2 como segunda opción en prevención primaria tras no alcanzar objetivos con metformina en pacientes con IMC>30kg/m2.
- •
No pueden prescribirse actualmente en personas con DM2 con tasas de filtrado glomerular estimado menores de 60ml/min.
- •
Deben tenerse en cuenta los posibles efectos adversos, tales las como infecciones genitales, las depleciones de volumen en personas ancianas con tratamiento diurético concomitante y otros más graves como la cetoacidosis diabética que ocurre con cifras a veces muy poco elevadas de glucemia y el peligro de amputaciones en personas con factores predisponentes.
Palabras clave
A partir de la floricina, un producto natural derivado de la corteza de la raíz del manzano que es conocido desde 1835, se sintetizaron fármacos selectivos de los inhibidores del cotransportador de sodio-glucosa 2 (i-SGLT2) con biodisponibilidad y eficacia suficiente para ser útiles en la clínica. Los i-SGLT2 que actúan en el túbulo proximal reducen la glucosa en sangre al aumentar la excreción de glucosa en orina1. La capacidad de reducir los niveles de glucosa en sangre y la hemoglobina glucosilada (HbA1c) están limitadas por la carga filtrada de glucosa y la diuresis osmótica causada por esta terapia; esto implica que su eficacia está condicionada a la conservación de una buena función renal. El efecto reductor de la glucosa es independiente de la insulina; por lo tanto, en ausencia de combinación con otros fármacos hipoglucemiantes no provocan hipoglucemias. Los i-SGLT2 disminuyen modestamente la presión arterial y el peso1,2.
Actualmente están comercializados cuatro principios activos de este grupo terapéutico: empagliflozina, canagliflozina, dapagliflozina y ertugliflozina.
2Resultados clínicos. Efectos beneficiososHemoglobina glicosilada (HbA1c). La terapia con i-SGLT2 en la diabetes mellitus tipo 2 (DM2) reduce los niveles de glu- cosa en plasma proporcionalmente a la concentración de glucosa ambiental y la filtración glomerular de esta glucosa.
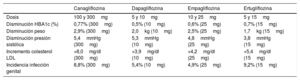
No hay ensayos que comparen directamente los inhibidores individuales de SGLT2. En los metaanálisis de red, las reducciones de HbA1c corregidas con placebo para la monoterapia y la terapia dual variaron de aproximadamente 0,6 a 0,9 y 0,3 a 0,6 puntos porcentuales, respectivamente3,4. Este hallazgo es similar en magnitud a los resultados con otros agentes hipoglucemiantes orales (tabla 1).
Dosis, eficacia clínica y seguridad de los i-SGLT21
| Canagliflozina | Dapagliflozina | Empagliflozina | Ertugliflozina | |
|---|---|---|---|---|
| Dosis | 100 y 300mg | 5 y 10mg | 10 y 25mg | 5 y 15mg |
| Disminución HBA1c (%) | 0,77% (300mg) | 0,5% (10mg) | 0,6% (25mg) | 0,7% (15mg) |
| Disminución peso | 2,9% (300mg) | 2,0kg (10mg) | 2,5% (25mg) | 1,7kg (15mg) |
| Disminución presión sistólica | 5,4mmHg (300mg) | 5,3mmHg (10mg) | 4,8mmHg (25mg) | 3,8mmHg (15mg) |
| Incremento colesterol LDL | +8,0mg/dl (300mg) | +3,9mg/dl (10mg) | +4,2mg/dl (25mg) | +5,4mg/dl (15mg) |
| Incidencia infección genital | 8,8% (300mg) | 5,4% (10mg) | 4,9% (25mg) | 9,2% (15mg) |
Pérdida de peso. La pérdida de energía inducida por la glucosuria conduce a la pérdida de peso que parece ser sostenida en el tiempo. En un metaanálisis de ensayos a más largo plazo (1 o 2 años), que comparaban los i-SGLT2 con placebo, hubo una reducción significativa en el peso con los i-SGLT2 [diferencia media a los 2 años: −2,99kg (intervalo de confianza [IC] del 95%: −3,64 a −2,34]5 (tabla 1).
Reducción de la presión arterial (PA). Los i-SGLT2 reducen la PA al promover la diuresis osmótica y la contracción del volumen intravascular. Este efecto no parece estar relacionado con la reducción de HbA1c como en los individuos con insuficiencia renal. Los i-SGLT2 disminuyen la PA sistólica 3,4-5,4mmHg y la presión arterial diastólica 1,5-2,2mmHg1 (tabla 1).
Beneficios cardiovasculares. En pacientes con enfermedad cardiovascular (ECV) establecida, la empagliflozina (ensayo EMPAREG6) y la canagliflozina (Ensayo CANVAS7) han mostrado una reducción de eventos cardiovasculares (variable combinada de muerte de origen cardiovascular, infarto de miocardio no mortal e ictus no mortal) respecto a placebo. En el caso de la empagliflozina, el estudio EMPA-REG OUTCOME: hazard ratio (HR): 0,86 (IC 95%, 0,74 a 0,99), número necesario a tratar (NNT) 62 en 3,1 años6. Con canagliflozina, el estudio CANVAS: HR: 0,86 (IC 95%, 0,75 a 0,97), NNT 218 en 2,4 años7. Por el contrario, dapagliflozina no consiguió dicha reducción: HR: 0,93 (IC 95%, 0,84 a 1,03) (ensayo DECLARE-TIMI 58)8 (tabla 2).
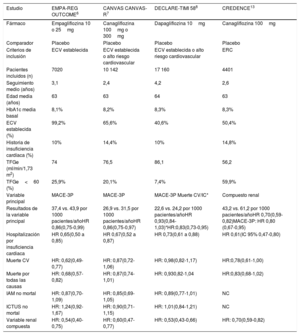
Características de los principales estudios de seguridad cardiovascular de los i-SGLT2 en pacientes con diabetes mellitus tipo 26–8,13
| Estudio | EMPA-REG OUTCOME6 | CANVAS CANVAS-R7 | DECLARE-TIMI 588 | CREDENCE13 |
|---|---|---|---|---|
| Fármaco | Empagliflozina 10 o 25mg | Canagliflozina 100mg o 300mg | Dapagliflozina 10mg | Canagliflozina 100mg |
| Comparador | Placebo | Placebo | Placebo | Placebo |
| Criterios de inclusión | ECV establecida | ECV establecida o alto riesgo cardiovascular | ECV establecida o alto riesgo cardiovascular | ERC |
| Pacientes incluidos (n) | 7020 | 10 142 | 17 160 | 4401 |
| Seguimiento medio (años) | 3,1 | 2,4 | 4,2 | 2,6 |
| Edad media (años) | 63 | 63 | 64 | 63 |
| HbA1c media basal | 8,1% | 8,2% | 8,3% | 8,3% |
| ECV establecida (%) | 99,2% | 65,6% | 40,6% | 50,4% |
| Historia de insuficiencia cardíaca (%) | 10% | 14,4% | 10% | 14,8% |
| TFGe (ml/min/1,73 m2) | 74 | 76,5 | 86,1 | 56,2 |
| TFGe<60 (%) | 25,9% | 20,1% | 7,4% | 59,9% |
| Variable principal | MACE-3P | MACE-3P | MACE-3P Muerte CV/IC* | Compuesto renal |
| Resultados de la variable principal | 37,4 vs. 43,9 por 1000 pacientes/añoHR 0,86(0,75-0,99) | 26,9 vs. 31,5 por 1000 pacientes/añoHR 0,86(0,75-0,97) | 22,6 vs. 24,2 por 1000 pacientes/añoHR 0,93(0,84-1,03)*HR:0,83(0,73-0,95) | 43,2 vs. 61,2 por 1000 pacientes/añoHR 0,70(0,59-0,82)MACE-3P: HR 0,80 (0,67-0,95) |
| Hospitalización por insuficiencia cardiaca | HR 0,65(0,50 a 0,85) | HR 0,67(0,52 a 0,87) | HR 0,73(0,61 a 0,88) | HR 0,61(IC 95% 0,47-0,80) |
| Muerte CV | HR: 0,62(0,49-0,77) | HR: 0,87(0,72-1,06) | HR: 0,98(0,82-1,17) | HR:0,78(0,61-1,00) |
| Muerte por todas las causas | HR: 0,68(0,57-0,82) | HR: 0,87(0,74-1,01) | HR: 0,930,82-1,04 | HR:0,83(0,68-1,02) |
| IAM no mortal | HR: 0,87(0,70-1,09) | HR: 0,85(0,69-1,05) | HR: 0,89(0,77-1,01) | NC |
| ICTUS no mortal | HR: 1,24(0,92-1,67) | HR: 0,90(0,71-1,15) | HR: 1,01(0,84-1,21) | NC |
| Variable renal compuesta | HR: 0,54(0,40-0,75) | HR: 0,60(0,47-0,77) | HR: 0,53(0,43-0,66) | HR: 0,70(0,59-0,82) |
CV: cardiovascular; ECV: enfermedad cardiovascular; ERC: enfermedad renal crónica; HR: hazard ratio; IC: insuficiencia cardíaca; MACE “major adverse cardiovascular events”: variable combinada de muerte cardiovascular, infarto de miocardio no mortal o ictus no mortal; TFGe: tasa de filtración glomerular estimada.
Por otra parte, empagliflozina, canagliflozina y dapagliflozina han mostrado reducir la hospitalización por insuficiencia cardíaca respecto a placebo6–8.
La ertugliflozina tiene en marcha un ensayo de seguridad cardiovascular (ensayo VERTIS CV9), en el que se han incluido personas con DM2 y ECV establecida, cuyas conclusiones han sido presentadas en el 80 congreso de la Asociación Americana de Diabetes (ADA) en junio 2020.
En un metaanálisis10 de los tres ensayos principales de resultados de ECV, los i-SGLT2, en comparación con placebo, redujeron el riesgo de eventos cardiovasculares adversos mayores (86,9 vs. 99,6 eventos por 1000 años-paciente, cociente de riesgos [HR] 0,89; IC 95%, 0,83-0,96) y un resultado compuesto de muerte cardiovascular u hospitalización por insuficiencia cardíaca (48,2 vs. 65,6 eventos por 1000 pacientes-año, HR, 0,77; IC 95%, 0,71-0,84). Los estudios observacionales han reportado hallazgos similares11,12. El beneficio clínico de los i-SGLT2 para reducir el riesgo de eventos cardiovasculares importantes, MACE (infarto de miocardio, accidente cerebrovascular, muerte cardiovascular), se limitó a aquellos pacientes con ECV aterosclerótica establecida, sin beneficio en aquellos con múltiples factores de riesgo de ECV (tabla 3). En contraste con los hallazgos de eventos cardiovasculares adversos mayores, el metaanálisis mostró una reducción en la hospitalización por insuficiencia cardíaca con el uso de i-SGLT2 independientemente de la presencia de ECV aterosclerótica o insuficiencia cardíaca establecida al inicio del estudio10 (tabla 3).
Metaanálisis de ensayos i-SGLT2 en el objetivo compuesto de infarto de miocardio, accidente cerebrovascular y muerte cardiovascular (eventos cardiovasculares adversos mayores) estratificado por la presencia de enfermedad cardiovascular aterosclerótica establecida
| Eventos/1000 pac./año Tratamiento | Eventos/1000 pac./año Placebo | HR (IC 95%) | ||
|---|---|---|---|---|
| Pacientes con enfermedad cardiovascular aterosclerótica | ||||
| EMPA-REG OUTCOME | 37,4 | 43,9 | 0,86 (0,74-0,99) | |
| CANVAS Program | 34,1 | 41,3 | 0,82 (0,72-0,95) | |
| DECLARE-TIMI 58 | 36,8 | 41,0 | 0,90 (0,79-1,02) | |
| Modelo efectos fijos | Enf. cardiosvascular aterosclerótica | (p=0,0002) | 0,86 (0,80-0,93) | |
| Pacientes con múltiples factores de riesgo | ||||
| CANVAS Program | 15,8 | 15,5 | 0,98 (0,74-1,30) | |
| DECLARE-TIMI 58 | 13,4 | 13,3 | ||
| Modelo efectos fijos | Múltiples factores de riesgo | (p=0,98) | 1,00 (0,87-1,16) |
Modificado de Zelniker TA et al10.
Es de destacar que, en comparación con los ensayos de empagliflozina y canagliflozina, el ensayo de dapagliflozina tuvo una fracción menor de participantes con ECV establecida y una mayor proporción de pacientes con múltiples factores de riesgo de ECV (factores de riesgo múltiples en 60% en comparación con 0% y 34% en el ensayo de empagliflozina y canagliflozina, respectivamente). Esta diferencia en la población de pacientes puede explicar, en parte, las diferencias en los resultados de la variable principal (MACE) ECV (tabla 2). Hasta que se realicen ensayos aleatorizados prospectivos y de gran tamaño se desconoce si la empagliflozina, la canagliflozina u otros i-SGLT2 tendrán efectos cardiovasculares similares en la mayoría de las personas con DM2 que no tienen ECV manifiesta.
Beneficios en nefropatía. En el ensayo CREDENCE13, diseñado específicamente para evaluar los resultados renales, 4401 pacientes con DM2 y macroalbuminuria (tasa de filtración glomerular estimada [TFGe] media de 56,2ml/min/1,73m2, relación mediana de albúmina-creatinina urinaria 927 [mg/g]) fueron asignados aleatoriamente a canagliflozina (100mg diarios) o placebo. El ensayo se detuvo temprano para obtener beneficios después de una mediana de seguimiento de 2,6 años. El resultado primario (una combinación de enfermedad renal en etapa terminal, duplicación de la creatinina sérica o muerte por causas renales o cardiovasculares) ocurrió en una proporción menor de pacientes que tomaban canagliflozina (43,2 vs. 61,2 eventos por 1000 años-paciente, HR 0,70; IC 95%, 0,59-0,82). El tamaño del efecto fue similar en todos los componentes del resultado primario, a excepción de la muerte renal, que ocurrió en pocos pacientes (2 vs. 5 muertes renales con placebo). El efecto protector renal fue más pronunciado en aquellos con una TFGe entre 45 y 60ml/min/1,73 m2 al inicio del estudio, pero se observó con una TFGe tan baja como 30ml/min/1,73m2 (tabla 2).
En el metaanálisis de Toyama et al.14 en personas con DM2 y enfermedad renal crónica (ERC) con 7363 participantes involucrados, los i-SGLT2 redujeron la hemoglobina glucosilada (−0,29%; IC 95%, −0,39 a −0,19), así como la PA, el peso corporal y la albuminuria. Los i-SGLT2 redujeron el riesgo de muerte cardiovascular, infarto de miocardio no mortal o accidente cerebrovascular no mortal (riesgo relativo [RR], 0,81; IC 95%, 0,70-0,94) e insuficiencia cardíaca (RR, 0,61; IC 95%, 0,48-0,78), sin un efecto claro sobre la mortalidad por todas las causas (HR, 0,86; IC 95% 0,73-1,01). Estos agentes también atenuaron la disminución de la TFGe y redujeron el riesgo del resultado renal compuesto (HR, 0,71; IC 95%, 0,53-0,95).
Beneficios en la insuficiencia cardíaca. En el ensayo DAPA-HF15, la dapagliflozina agregada a la terapia farmacológica optimizada y a la terapia con dispositivos redujo la mortalidad por todas las causas y mejoró la insuficiencia cardíaca en adultos con insuficiencia cardíaca y fracción de eyección reducida<40% (IC FEr), clase funcional II, III o IV de la Nueva York Heart Association con o sin diabetes. Un total de 4744 pacientes fueron asignados aleatoriamente a dapagliflozina 10mg una vez al día o placebo con una mediana de seguimiento de 18,2 meses.
La tasa de mortalidad por todas las causas se redujo significativamente con dapagliflozina en comparación con placebo (11,6 vs. 13,9%; RR, 0,83; IC 95%, 0,71-0,97). La muerte por causas cardiovasculares también se redujo significativamente con dapagliflozina (9,6 vs. 11,5%; HR, 0,82; IC 95%, 0,69-0,98). El resultado primario (compuesto de empeoramiento de la insuficiencia cardíaca o muerte cardiovascular) se redujo con dapagliflozina en comparación con placebo (16,3 vs. 21,2%; RR, 0,74, IC 95%, 0,65-0,85). Se produjo un empeoramiento de la insuficiencia cardíaca en 237 pacientes (10,0%) en el grupo de dapagliflozina y en 326 pacientes (13,7%) en el grupo de placebo (cociente de riesgos, 0,70; IC 95%, 0,59-0,83).
Los hallazgos en pacientes con diabetes fueron similares a los de los pacientes sin diabetes. La frecuencia de los eventos adversos, incluida la disminución del volumen, la disfunción renal y la hipoglucemia mayor, fueron similares en los dos grupos de tratamiento.
El ensayo DEFINE-HF16 proporcionó evidencia limitada adicional de beneficio de la dapagliflozina en comparación con placebo en 263 pacientes con IC FEr y nivel elevado de péptido natriurético. El uso de dapagliflozina durante 12 semanas no afectó a la NT-proBNP media, pero aumentó la frecuencia de mejoría clínica significativa en el estado de salud relacionado con la insuficiencia cardíaca o el nivel de péptido natriurético. Hubo efectos similares en pacientes con y sin diabetes.
En el estudio EMPA-HEART CardioLink 617 en personas con DM2 y enfermedad coronaria (n=97) con el objetivo primario de disminución de la masa ventricular izquierda (VI), el tratamiento con empagliflozina vs. placebo se asoció con una reducción significativa en la masa del VI indexada al área de la superficie corporal después de 6 meses (diferencia ajustada −3,35g/m2; IC 95%, −5,9 a −0,81g/m2, p=0,01) y una disminución de la presión arterial sistólica ambulatoria general (diferencia ajustada −6,8mmHg).
Como se comentó previamente, los metaanálisis de los ensayos clínicos han demostrado que los i-SGLT2 redujeron la hospitalización por insuficiencia cardíaca en personas con DM2, independientemente de la presencia de ECV aterosclerótica establecida o insuficiencia cardíaca al inicio del estudio.
3Resultados clínicos. Efectos adversos (tabla 4)Infecciones genitourinarias. En los metaanálisis de ensayos clínicos, los i-SGLT2 están significativamente asociados con un aumento de cinco veces en el riesgo de infecciones micóticas genitales (odds ratio [OR], 5,06; IC 95%, 3,44, 7,45), se informa que en hasta un 10% a 15% de las mujeres, y un aumento más modesto en infecciones urinarias (OR, 1,42; IC 95%, 1,06-1,90)18,19.
Beneficios y riesgos del uso de los i-SGLT2
| Beneficios | Riesgos |
|---|---|
| Disminución de HbA1c | Infecciones genitourinarias |
| Pérdida de peso | Cetoacidosis diabética |
| Disminución de la presión arterial | Amputaciones |
| Disminución MACE | Fracturas |
| Disminución ingreso por insuficiencia cardíaca | Depleción de volumen |
| Renoprotección | Gangrena de Fournier |
MACE “major adverse cardiovascular events”: variable combinada de muerte cardiovascular, infarto de miocardio no mortal o ictus no mortal.
Cetoacidosis diabética. En mayo de 2015, las agencias reguladoras emitieron una advertencia de que los i-SGLT2 podían causar cetoacidosis diabética (CAD)20. Los casos narrativos ilustran que la CAD asociada a i-SGLT2 puede ocurrir en pacientes con diabetes mellitus tipo 1 (DM1) diagnosticados incorrectamente como DM2, tal vez sin la presencia de factores desencadenantes evidentes de CAD. La incidencia de CAD asociada a i-SGLT2 fue inferior a 1/1000 en ensayos controlados aleatorios y 1,6/1000 persona-años en estudios de cohorte. En informes de casos de CAD asociados con i-SGLT2, el 35% mostró niveles de glucosa de menos de 200mg/dl y el 22% no se asoció con desencadenantes típicos. En los informes de casos y en las bases de datos de farmacovigilancia, la duración del tratamiento con i-SGLT2 antes del inicio de la CAD fue extremadamente variable. Los episodios fatales de CAD asociados a i-SGLT2 se encontraron solo en bases de datos de farmacovigilancia y representaron el 1,6% de todos los casos informados. La CAD es un evento adverso raro durante la terapia con i-SGLT2. Los factores predisponentes y precipitantes aún se entienden de manera incompleta, y una minoría de los casos carecía de desencadenantes de CAD típicos21.
Riesgo de amputación de extremidades inferiores. El tratamiento con canagliflozina podría incrementar el riesgo de amputación no traumática en miembros inferiores (fundamentalmente los dedos de los pies) en pacientes diabéticos7,22. Hasta el momento no ha podido dilucidarse el mecanismo causal que explique esta circunstancia. La frecuencia de los informes que tienen la amputación como un evento adverso entre todos los informes que enumeran la canagliflozina como sospechosa o concomitante fue de 3,4 por 1000 (IC 95%, 2,6-4,6). La frecuencia de informes con amputación como un evento adverso con canagliflozina fue significativamente mayor que la frecuencia de las amputaciones en los informes presentados para medicamentos no i-SGLT2, con una relación proporcional (PRR) de 5,33 (IC 95%, 4,04-7,04; p<0,0001); en comparación, el PRR para dapagliflozina fue 0,25 (0,03-1,76; p=0,163) y para empagliflozina, de 2,37 (0,99-5,70; p=0,054)23.
Fracturas óseas. Se ha observado un leve incremento de fracturas en los pacientes tratados con canagliflozina (1,4-1,5%/año de exposición). Aunque no se ha establecido la relación causal de dicho efecto, podría deberse a un aumento de las caídas a consecuencia de la depleción de volumen20. Otros estudios retrospectivos encuentran tasas similares de fracturas de miembros inferiores comparativamente con otros hipoglucemiantes24,25.
Grangrena de Fournier. Finalmente, es interesante indicar que recientemente la Agencia Europea del Medicamento (EMA) ha ordenado la inclusión en las fichas técnicas y prospectos de los i-SGLT2 de una advertencia respecto a la fascitis necrotizante perineal, una infección poco frecuente, pero de alta mortalidad, también llamada gangrena de Fournier26.
4Lugar en la terapéutica de la DM2. Opciones de tratamientoLos i-SGLT2 no se consideran una terapia inicial para la mayoría de las personas con DM2. La terapia inicial en la mayoría de estas personas debe comenzar con dieta, reducción de peso, ejercicio y metformina (en ausencia de contraindicaciones).
Debe ser una opción preferente en prevención secundaria:
- 1.
En personas con DM2 y ECV aterosclerótica manifiesta que no alcanzan los objetivos glucémicos con metformina y modificaciones en el estilo de vida junto a los agonistas del receptor del péptido similar al glucagón tipo 1 (a-GLP1)27.
- 2.
En personas con DM2 e insuficiencia cardíaca que no alcanzan los objetivos glucémicos con metformina y modificaciones en el estilo de vida.
- 3.
En personas con DM2 y nefropatía (albúmina a creatinina en orina > 300mg/g y TFGe > 60ml/min/1,73m2).
En una revisión sistemática y metaanálisis comparativo de i-SGLT2 vs. a-GLP127 sobre la prevención de eventos cardiovasculares, insuficiencia cardíaca y ERC en personas con DM2, a-GLP1 e i-SGLT2 reducen el MACE aterosclerótico a un grado similar en pacientes con ECV establecida, 12% vs. 11%, mientras que los i-SGLT2 redujeron los ingresos por insuficiencia cardíaca un 31% (HR, 0,69; IC 95%, 0,61-0,79, p<0,001) mientras que los a-GLP1 no tuvieron un efecto significativo (HR, 0,93; IC 95%, 0,83-1,04, p=0,20). Ambos a-GLP1 (HR, 0,82; IC 95%, 0,75-0,89, p<0,001) e i-SGLT2 (HR, 0,62; IC 95%, 0,58-0,67, p<0,001) redujeron el riesgo de progresión de enfermedad renal que incluye macroalbuminuria, pero solo los i-SGLT2 redujeron el riesgo de empeoramiento de la TFGe, la etapa final de la enfermedad renal o muerte renal (HR, 0,55; IC 95%, 0,48-0,64, p<0,001).
Se debe considerar como segunda opción en prevención primaria tras no alcanzar objetivos con metformina en pacientes con IMC>30kg/m2 y en los que el aumento de peso, la PA o las hipoglucemias se presenten como objetivos prioritarios, junto a los a-GLP1 y los i-DPP4.
En un metaanálisis en red que incluye 236 ensayos con 176 310 participantes, el uso de i-SGLT2 o a-GLP1 se asoció significativamente con una menor mortalidad por todas las causas en comparación con los grupos de control (placebo o ningún tratamiento) (cociente de riesgos HR, 0,80 y HR, 0,88, respectivamente) y con i-DPP4 (HR, 0,78 y HR, 0,86, respectivamente)28.
En terapia combinada pueden utilizarse junto a cualquier otro hipoglucemiante, incluida la insulina.
Como agente de tercera línea en pacientes no controlados adecuadamente con metformina y terapia con insulina, en quienes los agonistas del receptor del péptido-1 similar al glucagón (GLP-1) están contraindicados y el aumento de la dosis de insulina conduciría a un aumento de peso.
Será otra opción frente al resto de hipoglucemiantes en prevención primaria como segundo agente en pacientes con IMC<30kg/m2 y control inadecuado con metformina en quienes el aumento de peso y el riesgo de hipoglucemia son un problema importante. Se desconocen los beneficios y riesgos a largo plazo de usar una combinación sobre otra de hipoglucemiantes añadidos a metformina. Hay una escasez de ensayos comparativos de alta calidad y de comparación directa de medicamentos con importantes criterios de valoración clínicos, como los efectos sobre las complicaciones microvasculares y macrovasculares y la mortalidad. La elección de la terapia debe individualizarse según las características, preferencias y costes del paciente.
Contraindicaciones y precauciones: los i-SGLT2 no deben usarse para el tratamiento de la hiperglucemia en pacientes con:
- •
DM1 (excepto dapagliflozina. Solo autorizada en pacientes con IMC>27kg/m2 en pacientes tratados con insulina y con dosis mayores de 0,5U/kg de peso/día)29.
- •
Personas con DM2 y TFGe<60ml/min/1,73 m2 o<45ml/min/1,73 m2 una vez comenzado el tratamiento con i-SGLT2 (ficha técnica). Es posible que estos umbrales de TFGe varíen a la luz de los últimos ensayos clínicos13. Actualmente permitidos para comenzar el tratamiento hasta TFGe de 30ml/min/1,73m2 en Canadá30.
- •
Cetoacidosis diabética con anterioridad o factores que predisponen a ella (insuficiencia pancreática, adicciones a alcohol u otras drogadicciones, etc.).
- •
Infecciones bacterianas frecuentes del tracto urinario o infecciones genitourinarias micóticas.
- •
Osteoporosis y alto riesgo de fracturas y caídas.
- •
Ulceración del pie o riesgo elevado de ulceración (enfermedad arterial periférica sintomática, pérdida de sensibilidad propioceptiva en pie, etc.).
- •
Deben usarse con precaución en personas con riesgo de deshidratación por tratamientos concomitantes que puedan producir cuadros de hipovolemia e insuficiencia renal aguda (antiinflamatorios no esteroideos, inhibidores de la enzima de conversión de la angiotensina, antagonistas de los receptores de la angiotensina II y diuréticos) que pueden ser más intensos en personas de edad avanzada.
Actualmente están comercializados cuatro principios activos de este grupo terapéutico: empagliflozina, canagliflozina, dapagliflozina y ertugliflozina.
Existen pocos datos sobre los beneficios y riesgos en pacientes que no han tenido un evento cardiovascular importante. En los pacientes sin ECV, la elección del i-SGLT2 a menudo depende del coste, ya que los ensayos publicados no han revelado diferencias sustanciales con respecto a la reducción de A1c, la reducción de peso o el riesgo de infecciones micóticas.
Un reciente metaanálisis en red comparativo de ertugliflozina31 analiza la comparativa con otros i-SGLT2 para evaluar la eficacia y seguridad en el tratamiento de la DM2 en tres tipos de poblaciones con mal control metabólico (HbA1c superior a 7%): 1) con dieta y ejercicio sin fármacos añadidos, 2) utilizando la metformina sola y 3) con metformina y además un i-DPP4.
En pacientes no controlados con dieta y/o ejercicio, la eficacia de la ertugliflozina 5mg en monoterapia no fue significativamente diferente en términos de reducción de la HBA1c a los otros i-SGLT2 en dosis bajas; sin embargo, en dosis de 15mg, la ertugliflozina fue más efectiva que la dapagliflozina de 10mg, diferencia media (MD): −0,36% (IC 95%, −0,65 a −0,08) y que la empagliflozina 25mg, MD: −0,31% (IC 95%, −0,58 a −0,04).
Como medicación añadida a la metformina, la ertugliflozina 5mg fue más efectiva en la reducción de la HbA1c que la dapagliflozina 5mg, MD: −0,22% (IC 95%, −0,42 a −0,02). La ertugliflozina 15mg fue más efectiva en la reducción de la HbA1c que la dapagliflozina 10mg, MD: −0,26% (IC 95%, −0,46 a −0,06) y que la empagliflozina 25, MD: −0,23% (IC 95% −0,44 a −0,03). Las reducciones de la HbA1c de la ertugliflozina no fueron distintas a las producidas por la canagliflozina en todas las poblaciones.
En relación con priorizar el tratamiento con i-SGLT2 en personas con DM2 y ECV aterosclerótica, insuficiencia cardíaca o enfermedad renal crónica, las preferencias según los resultados en los ensayos de seguridad cardiovascular serían:
- •
Empagliflozina y canagliflozina, en pacientes con ECV aterosclerótica.
- •
Dapagliflozina, empagliflozina y canagliflozina en insuficiencia cardíaca.
- •
Canagliflozina, empaglifozina y dapagliflozina en ERC.
La dosificación de los distintos i-SGLT2 es la siguiente:
- •
Canagliflozina: se toma por vía oral antes de la primera comida del día. La dosis inicial es de 100mg una vez al día, y se puede aumentar a 300mg al día para alcanzar los objetivos glucémicos.
- •
Dapagliflozina: se toma por vía oral, 10mg a cualquier hora del día con o sin alimentos. Para pacientes con función hepática gravemente reducida, se recomienda una dosis inicial de 5mg.
- •
Empagliflozina: se toma por vía oral una vez al día por la mañana con o sin alimentos. La dosis inicial es de 10mg diarios, y se puede aumentar a 25mg una vez al día para alcanzar los objetivos glucémicos.
- •
Ertugliflozina: se toma una vez al día por la mañana con o sin alimentos. La dosis inicial es de 5mg una vez al día y puede aumentarse a una dosis máxima de 15mg una vez al día para alcanzar los objetivos glucémicos.
Hasta la fecha, en España los i-SGLT2 no pueden prescribirse con TFGe<60ml/min/1,73 m2 y deben suspenderse si una vez comenzado el tratamiento la TFGe es<45ml/min/1,73 m2. Es muy probable que estos umbrales de TFGe en función de los ensayos realizados se permitan hasta TFGe>30ml/min/1,73 m2 para el comienzo de la prescripción de i-SGLT2.
6Próximos ensayos clínicos sobre i-SGLT2Se espera completar varios ensayos clínicos aleatorizados de i-SGLT2 durante los próximos 3 a 4 años. Estos incluyen ensayos de resultados renales para empagliflozina (EMPA-KIDNEY, ClinicalTrials.gov No. NCT03594110)32 y dapagliflozina (DAPA-CKD, ClinicalTrials.gov No. NCT03036150), así como ensayos de insuficiencia cardíaca que inscribieron participantes con fracción de eyección reducida y preservada (es decir, EMPEROR-Reduced, ClinicalTrials.gov No. NCT03057977; EMPEROR-Preserved, ClinicalTrials.gov No. NCT03057951; y ENTREGA, ClinicalTrials.gov No. NCT03619213). Debido a los distintos mecanismos de los i-SGLT2 que producen beneficios no glucémicos, estos ensayos reclutan participantes con y sin diabetes. El recientemente ensayo DAPA-HF15 completado mostró que la dapagliflozina redujo el ingreso por insuficiencia cardíaca en personas con insuficiencia cardíaca y FEr independientemente del estado de la diabetes, proporcionando más evidencia de que estos medicamentos pueden beneficiar a las personas sin diabetes.
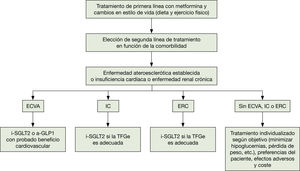
Los i-SGLT2 proponen un cambio de práctica del desarrollo en el tratamiento de DM2 por los datos de protección cardiovascular, renal y en la insuficiencia cardíaca. Los tratamientos deben seleccionarse en función del órgano terminal de protección y las comorbilidades del paciente en lugar de centrarse solo en la reducción de los niveles de glucosa33. Se muestra el algoritmo de la ADA-EASD 201834 (fig. 1).
Algoritmo terapéutico hipoglucemiante en la DM2. Elaborada a partir del algoritmo de tratamiento de la DM2. ADA-EASD 201834. a-GLP1: agonista del receptor del péptido similar al glucagón tipo 1; CV: cardiovascular; ECVA: enfermedad cardiovascular aterosclerótica; ERC: enfermedad renal crónica; IC: insuficiencia cardíaca; i-SGLT2: inhibidor del cotransportador de sodio-glucosa tipo 2; TFGe: tasa de filtración glomerular estimada.
Los i-SGLT2 se expresan en el túbulo proximal y median la reabsorción de aproximadamente el 90% de la carga de glucosa filtrada. Los i-SGLT2 promueven la excreción renal de glucosa y, por lo tanto, en ausencia de combinación con otros fármacos hipoglucemiantes no provocan hipoglucemia. Por lo general, no causan hipoglucemia en ausencia de terapias que de otro modo causen hipoglucemia. Los i-SGLT2 disminuyen la presión arterial y el peso.
Los i-SGLT2 no se consideran una terapia inicial para la mayoría de las personas con DM2. En ausencia de contraindicaciones, la metformina debe ser la terapia farmacológica inicial.
Las opciones terapéuticas para las personas con DM2 sin ECV previa que fracasan en la terapia inicial con intervención en el estilo de vida y metformina son agregar un segundo agente no insulínico. La elección de la terapia debe ser individualizada en función de las características, preferencias y costes del paciente. Las opciones incluyen, sulfonilureas/glinidas, a-GLP1, pioglitazona, i-DPP4 o i-SGLT2.
En personas con DM2 y ECV aterosclerótica manifiesta que no alcanzan los objetivos glucémicos con metformina y modificaciones en el estilo de vida, la empagliflozina o la canagliflozina deben ser prioritarias, y la dapagliflozina, la empagliflozina y la canagliflozina en personas DM2 con insuficiencia cardíaca.
En personas con DM2 y nefropatía (excreción de albúmina urinaria>300mg/día) y FGe>60ml/min/1,73 m2son de elección canagliflozina, empagliflozina y dapagliflozina.
Se deben considerar los i-SGLT2 como segunda opción en prevención primaria tras no alcanzar objetivos con metformina en pacientes con IMC>30kg/m2, en los que el aumento de peso, o la PA o las hipoglucemias se presenten como objetivos prioritarios, junto a los a-GLP1.
El estado del volumen y la función renal (creatinina sérica con estimación de la TFGe) deben evaluarse antes de comenzar un i-SGLT2 y periódicamente después. Los pacientes que toman i-SGLT2 deben ser monitorizados para detectar signos y síntomas de infecciones del tracto genitourinario y ulceración del pie.
Los efectos secundarios más comunes de los i-SGLT2 son las infecciones por cándida vulvovaginal y la hipotensión. También se ha informado lesión renal aguda, infecciones del tracto urinario, fascitis necrotizante del perineo, cetoacidosis diabética euglucémica, mayor riesgo de amputación de las extremidades inferiores y fracturas óseas.