- •
En los últimos años, la resistencia a los antibióticos se ha intensificado, y se ha convertido en una amenaza para la salud pública.
- •
El consumo de antibióticos está directamente relacionado con el desarrollo de resistencias.
- •
La presión selectiva de los antibióticos sobre las bacterias se incrementa a medida que se alarga la duración del tratamiento.
- •
La duración de los tratamientos es uno de los aspectos que hay que tener en cuenta en la valoración de la idoneidad de la antibioticoterapia.
- •
La disminución de la duración del tratamiento antibiótico es una de las estrategias clave de los programas de optimización del uso de antibióticos.
- •
Los tratamientos cortos han demostrado ser eficaces, con menos efectos adversos y riesgo de selección de resistencias, además de ser más económicos y favorecer la adherencia al tratamiento.
- •
El elevado consumo de antibióticos y el importante porcentaje de tratamientos inapropiados en la atención primaria ofrece una gran oportunidad para su optimización.
- •
Gran parte de las infecciones atendidas a nivel de la atención primaria pueden ser tratadas con cursos de tratamientos antibióticos iguales o inferiores a 7 días.
- •
Es necesario promover el cambio hacia la optimización de las duraciones de los tratamientos antibióticos lo más cortas posible, según la evidencia disponible.
- •
Actualmente, no hay evidencia para indicar tratamientos cortos en pacientes con inmunosupresión, infecciones graves, infecciones quirúrgicas con mal control del foco o infecciones protésicas.
Palabras clave
Se estima que las infecciones causadas por bacterias resistentes arrojan un saldo de unas 33.000 muertes al año en Europa. En España, según los datos del Registro del Conjunto Mínimo Básico de Datos (CMBD), en el año 2016 murieron casi 3.000 personas como consecuencia de este tipo de infecciones1. La estimación según un reciente estudio español arroja cifras aún más alarmantes: las muertes atribuidas a infecciones por bacterias multirresistentes se calculan en 35.400 al año, cifra 30 veces superior a la de los accidentes de carretera2. A esto se suma un coste añadido de 1.500 millones de euros anuales en la Unión Europea (UE), y alrededor de 150 millones de euros anuales a nivel español1. Son, además, infecciones más difíciles de tratar debido a la disminución o ausencia de antibióticos eficaces3.
Si se mantiene la tendencia y no se toman medidas urgentes al respecto, se prevé que la mortalidad anual alcanzará los 10.000.000 a nivel mundial y los 390.000 en Europa en el año 2050, colocándose por delante de las muertes atribuidas al cáncer4.
Frente a este preocupante panorama han emergido una serie de estrategias encaminadas a luchar en contra de este fenómeno, entre las que se encuentra el desarrollo de los programas de optimización del uso de antimicrobianos (PROA, antibiotic stewardship programs en inglés), cuyo objetivo principal es mejorar los resultados clínicos de los pacientes con infecciones, minimizando los efectos adversos asociados a la utilización de antimicrobianos y garantizando la utilización de tratamientos coste-eficaces5.
Una de las intervenciones clave de estos programas es promover la duración mínima indispensable de los tratamientos antibióticos para asegurar la resolución clínica con la menor carga de efectos indeseables, entre los que se cuentan la aparición y diseminación de resistencias y la diarrea por Clostridium difficile5–7.
Consumo de antibióticos y desarrollo de resistenciasEl proceso natural de evolución de las bacterias contempla el desarrollo de mecanismos de resistencia que se ven incrementados por la presión selectiva que ejercen los antibióticos. La sobreutilización de los antibióticos se ha relacionado claramente con la aparición de resistencias, no solo a nivel global, sino también a nivel individual8. Una revisión sistemática y metaanálisis de estudios en pacientes de atención primaria mostró que el uso de antibióticos se asocia a la aparición de resistencias al menos durante los primeros 12 meses postratamiento, una relación que es más fuerte en los primeros 2 y 3 meses9.
Actualmente, la aparición y evolución de las resistencias no es solo un problema a nivel hospitalario. Cada vez es más frecuente la detección de microorganismos resistentes en la comunidad y la identificación de personas sanas como reservorios de bacterias resistentes10.
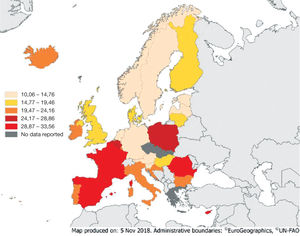
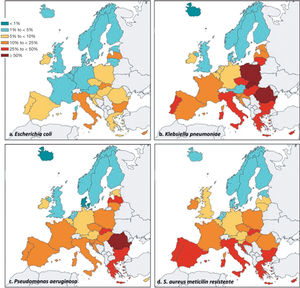
España es uno de los países del mundo con mayor consumo de antibióticos a nivel mundial y europeo11,12. En 2017 se situaba como el segundo consumidor europeo a nivel comunitario, por detrás de Chipre, y en primer lugar si se incluyen datos de consumo hospitalario12 (fig. 1). Este elevado consumo se acompaña de tasas de resistencia superiores en los países del sur y este de Europa con respecto a los países del norte13 (fig. 2).
Consumo de antibacterianos (ATC grupo J01) en la comunidad en 2017, expresados en dosis diarias definidas (DDD) por 1.000 habitantes por día (DHD)12.
Porcentaje de resistencias. a y b) Escherichia coli y Klebsiella pneumoniae: porcentaje de resistencia combinada a cefalosporinas de tercera generación, fluorquinolonas y aminoglicósidos; c) Pseudomonas aeruginosa: porcentaje de resistencia combinada (resistencia a tres o más antimicrobianos entre piperacilina/tazobactam, ceftazidima, fluoroquinolonas, aminoglicósidos y carbapenems); d) Staphylococcus aureus resistente a la meticilina (MARSA). Los datos se basan exclusivamente en aislados de hemocultivos y líquido cefalorraquídeo13.
En el ámbito de la atención primaria se realizan del 80% al 90% de las prescripciones de antibióticos, y se estima que el 50% de estas son inapropiadas, bien sea por indicación, selección, dosis y/o duración del tratamiento12,14, de manera que tenemos una gran oportunidad para optimizar los tratamientos. En nuestro país, una de cada tres consultas a los médicos de familia está relacionada con posibles enfermedades infecciosas y el 75-85% de las prescripciones de antibióticos se utilizan en enfermedades respiratorias15.
La disminución de la exposición global a los antibióticos es una de las piedras angulares de la lucha en contra de las resistencias antimicrobianas. A nivel de la atención sanitaria, las estrategias para conseguirlo pasan por evitar tratamientos innecesarios y acortar las duraciones de los tratamientos antibióticos, disminuyendo así la presión selectiva sobre las bacterias5,6,16.
Pero.. ¿es posible acortar el tratamiento antibiótico?Curiosamente, las duraciones tradicionales de los tratamientos antibióticos se han fijado en 7 días o sus múltiplos –14, 28 días...–, no siempre basándose en la evidencia. La elección de este período ha venido influenciada por los 7 días que dura 1 semana y que algún experto ha denominado “las unidades de Constantino”, en alusión al establecimiento de la duración de la semana de 7 días por el Emperador Constantino el Grande en el año 321 a. C.17.
La propuesta de reducción de las duraciones de los tratamientos antibióticos se basa, por un lado, en el rápido efecto de los antibióticos (clínicamente visible en los primeros 3-4 días y con una eficacia máxima a los 5-8 días del inicio) y, por otro, en el hecho de que la selección de mutantes resistentes comienza a partir de los 3-4 días del inicio del tratamiento y se incrementa a medida que aumenta el tiempo de exposición6.
Actualmente hay suficiente evidencia que apoya el uso de tratamientos cortos en diferentes tipos de infecciones6. La comparación de tratamientos antibióticos cortos frente a los tratamientos estándar en pacientes adultos hospitalizados arrojó porcentajes similares de curación clínica y microbiológica, mortalidad y recaída, con la ventaja de que los pacientes con tratamientos cortos presentaron un 9% menos de riesgo de desarrollar infecciones por microorganismos multirresistentes. Las infecciones incluidas en esta revisión sistemática y metaanálisis fueron la neumonía adquirida en la comunidad, neumonía asociada a ventilación mecánica, infección del tracto urinario e infección intrabdominal18. Los mismos resultados se observaron en la neumonía adquirida en la comunidad (NAC), la otitis media aguda, la sinusitis bacteriana aguda, la cistitis y la pielonefritis en el ámbito de la atención primaria en una revisión de revisiones sistemáticas19. A igualdad de eficacia clínica, estos tratamientos presentan menos efectos adversos y riesgo de selección de resistencias, son más económicos y tienen el potencial de favorecer la adherencia al tratamiento20.
A continuación, comentaremos la duración reducida de antibióticos en las infecciones más prevalentes en atención primaria.
Faringoamigdalitis aguda (FA): en esta infección tiene una gran importancia, a la hora de decidir iniciar tratamiento antibiótico, diferenciar si la infección está causada por Streptococcus pyogenes o por virus. Esta decisión en ocasiones no debe estar basada solo en síntomas y signos clínicos que pueden ser poco discriminativos. Las pruebas rápidas de detección de antígeno “point-of-care” tienen una sensibilidad y especificidad elevadas y son muy útiles en niños de más de 3 años con evidencia clínica de FA y ausencia de signos y síntomas de infección vírica21. El antibiótico de elección es amoxicilina oral y en alérgicos, una cefalosporina de primera generación (reacción no anafiláctica) o clindamicina, claritromicina o azitromicina. La duración del tratamiento de la FA se ha establecido en 10 días, para evitar la colonización persistente y el riesgo de complicaciones como la fiebre reumática, excepto para la azitromicina que se establece en 5 días22,23.
Sinusitis aguda: la sinusitis aguda es generalmente una complicación de una infección vírica de las vías respiratorias altas que se presenta en el 5-10% de los casos en niños pequeños y en el 1-2% de las que afectan a los adultos. El tratamiento es amoxicilina a dosis altas, asociada o no a ácido clavulánico. La duración del tratamiento, si la evolución es correcta, se establece en 5 días en adultos y 10 días en niños23–25.
Otitis media aguda (OMA): la otitis media con exudado (OME) es una entidad que puede producirse después de un episodio de OMA o como consecuencia de una disfunción de la trompa de Eustaquio secundaria a una infección del tracto respiratorio superior. Así mismo, la OME puede predisponer al desarrollo de una OMA. Dado que la OME no requiere tratamiento antibiótico, es muy importante diferenciar clínicamente ambas entidades a la hora de evitar el uso inadecuado de los antibióticos. La OMA tiene una elevada tasa de curación espontánea y un riesgo muy bajo de complicaciones, por lo que en la mayoría de los niños con OMA leve, lo más adecuado es la visita diferida y únicamente tratar si los síntomas persisten o empeoran a las 48-72 horas. Está indicado el tratamiento antibiótico en niños menores de 2 años y especialmente en menores de 6 meses por el riesgo de complicaciones y recidiva, en OMA severa (fiebre ≥ 39°C y/u otalgia intensa) y OMA con otorrea. El tratamiento de elección en los cuadros leves es amoxicilina y en los severos o en niños menores de 6 meses, amoxicilina-ácido clavulánico. Si fracasa el tratamiento anterior, el antibiótico de elección es ceftriaxona intramuscular durante 3 días. En casos de alergia a la penicilina sin reacción anafiláctica, el tratamiento es cefuroxima o si existe el antecedente de reacción anafiláctica (tipo 1): azitromicina o claritromicina. La duración del tratamiento se establece en 7-10 días en menores de 2 años, OMA severa o recurrencias y de 5 a 7 días en los mayores de 2 años y OMA leve-moderada26.
Neumonía adquirida en la comunidad: una de las patologías en las que se debe reducir de forma sustancial el consumo de antibióticos es en la NAC. A menudo se tratan infecciones víricas con este pretexto y frecuentemente la duración de la antibioticoterapia en las que sí la requieren supera las recomendaciones establecidas.
Una revisión sistemática no mostró diferencias al comparar pautas cortas de 3-7 días con las superiores a los 7 días en el tratamiento de la NAC27. En un ensayo clínico controlado y aleatorizado que incluía también neumonías graves se demostró que el tratamiento intravenoso con amoxicilina durante 3 días era tan eficaz como la pauta de 8 días28. Basándose en ello, las guías de la Infectious Diseases Society of America (IDSA) recomiendan una duración de 5 días si el paciente resta apirético desde 48 horas antes y estable hemodinámicamente29.
En definitiva, la NAC del adulto puede ser tratada durante 5 días en gran parte de los casos20.La presencia de neumonía bacteriémica por Staphylococcus aureus, empiema, absceso pulmonar, neumonía necrosante o Legionella puede requerir un tratamiento más prolongado.
Exacerbación de la EPOC: el tratamiento antibiótico no está recomendado para todos los pacientes con exacerbación, ya que su etiología no está siempre relacionada con una infección bacteriana. Es necesario valorar tanto la gravedad del episodio como las características de la presentación clínica que identifiquen síntomas y signos que sugieran la presencia de infección bacteriana30. Clásicamente se han utilizado los criterios de Anthonisen31 (disnea, incremento del volumen del esputo o de su purulencia) para decidir la instauración de la antibioticoterapia. La presencia de estos tres síntomas cardinales son indicación de tratamiento antibiótico.
La duración de tratamiento antibiótico recomendada es entre 5 y 7 días. Una revisión sistemática de 10 ensayos aleatorizados demostró que tratamientos de 7 días o menos, en comparación con mayor número de días, no provocó mayor fracaso terapéutico32. En el caso de infección por Pseudomonas aeruginosa, el tratamiento puede prolongarse hasta 10-14 días30.
Bacteriuria asintomática: a través de los PROA se ha detectado que el tratamiento de la bacteriuria asintomática contribuye de manera importante al uso inapropiado de los antimicrobianos8. La evidencia muestra beneficio en el tratamiento de la bacteriuria asintomática en mujeres embarazadas (durante 4-7 días o con una dosis única de fosfomicina trometamol 3g) y en pacientes sometidos a manipulación urológica con alto riesgo de sangrado de la mucosa, previo al procedimiento8,33,34.
Cistitis: a nivel global, la cistitis aguda no complicada es una de las causas más comunes de prescripción de antimicrobianos y es el tipo más frecuente de infección del tracto urinario (ITU)35. La eficacia de las pautas cortas de tratamiento ha sido ampliamente demostrada en cistitis aguda no complicada en mujeres, estableciéndose la recomendación de tratamiento entre 1 y 5 días, en función del antibiótico utilizado. La fosfomicina trometamol 3g en dosis única o la nitrofurantoína durante 5 días son de elección34–36. Sin embargo, en presencia de factores que puedan complicar la infección (inmunosupresión, embarazo, ITU en hombres, alteraciones urológicas, evolución lenta) se recomienda tratamientos más largos, de al menos 7 días33,34. En el caso de mujeres diabéticas controladas y sin alteraciones urológicas se podrían utilizar pautas cortas de infecciones no complicadas35–37. En el caso de este tipo de infección en hombres, sin otros factores de complicación, dos estudios observacionales recientes sugieren que tratamientos de más de 7 días no reducen el riesgo de recurrencia7,38. Actualmente está en marcha un ensayo clínico aleatorizado con la intención de comparar el beneficio clínico de pautas de 7 días con las de 14 días, que arrojará una evidencia más sólida en este grupo poblacional38.
Pielonefritis: la eficacia clínica y microbiológica de los tratamientos de 7 días o menos para la pielonefritis aguda (PNA), con o sin bacteriemia, fue comparable a la de los tratamientos de más de 7 días, excepto en el subgrupo de pacientes con alteraciones urogenitales, en los que la eficacia microbiológica fue ligeramente superior en los tratamientos más largos, según una revisión y metaanálisis de 8 ensayos clínicos aleatorizados39. En las guías, las duraciones de los tratamientos varían según el antibiótico utilizado: 5-7 días para quinolonas (levofloxacino, ciprofloxacino), 7-10 días para cefalosporinas y amoxicilina/clavulánico, 10-14 días para cotrimoxazol33,34,40. No hay estudios controlados de cotrimoxazol con duraciones inferiores a 14 días, pero en la práctica clínica se ha visto que, en caso de respuesta clínica adecuada, 10 días serían suficientes34. Un ensayo clínico reciente mostró que, en pacientes hombres y mujeres no embarazadas ingresados por pielonefritis (excluyendo pacientes con sepsis, abscesos, prostatitis, ITU recurrente o asociada a sonda vesical u obstrucción del tracto urinario) y con evolución clínica favorable, el tratamiento durante 7 días resultó ser no inferior al de 14 días, con re-gímenes que no incluían fluorquinolonas41. En el caso de -infecciones complicadas graves y con lenta respuesta al tratamiento podrían ser necesarios tratamientos más prolongados, probablemente a nivel hospitalario33,34.
ITU asociada a sonda vesical: se recomienda una duración de 7 días en caso de resolución rápida de los síntomas y evolución favorable (o 5 días de levofloxacino). En mujeres con ITU inferior tras la retirada de la sonda considerar solo 3 días de tratamiento o una dosis única de fosfomicina trometamol 3g34. Se debe recordar que la presencia de piuria aislada no es indicador de infección, y no debe ser criterio de inicio de tratamiento antibiótico. Tampoco la turbidez y el olor de la orina deben usarse para diferenciar entre bacteriuria asintomática e infección33.
Prostatitis aguda: las guías europeas recomiendan una duración mínima de 2 semanas, que se alargarán hasta 4 semanas en función de la resolución de los síntomas. Las quinolonas y el cotrimoxazol son los antibióticos que presentan mejor perfil respecto a la penetración en la próstata, pero su uso empírico está limitado por las resistencias. Se podría iniciar el tratamiento con cefuroxima, y en función del antibiograma del urocultivo cambiar a ciprofloxacino o cotrimoxazol33,42.
Celulitis y erisipela: la duración de la terapia es otra fuente de preocupación en muchas infecciones relacionadas con tratamientos indebidamente prolongados. El tratamiento en caso de celulitis o erisipela no complicadas deberá mantenerse durante 5 días. En casos de formas graves o extensas deberá ampliarse la duración entre 14 y 21 días43,44.
Abscesos y forúnculo: el tratamiento de elección en el caso de los abscesos y furúnculos en las formas leves es la incisión y desbridamiento, sin requerir tratamiento antibiótico. En el caso de los abscesos múltiples o recurrentes, edades extremas o signos de infección sistémica, se recomienda después de obtener material para cultivo, el inicio de tratamiento antibiótico durante 5-10 días44.
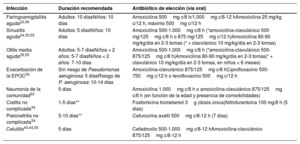
En la Tabla 1 se detalla la duración recomendada del tratamiento antibiótico y la pauta de elección para algunas de las infecciones más comunes en atención primaria.
Duración recomendada del tratamiento antibiótico y pauta de elección para algunas de las infecciones más comunes en atención primaria
| Infección | Duración recomendada | Antibiótico de elección (vía oral) |
|---|---|---|
| Faringoamigdalitis aguda22,56 | Adultos: 10 díasNiños: 10 días | Amoxicilina 500mg c/8 h/1.000mg c/8-12 hAmoxicilina 25 mg/kg c/12 h, máximo 500mg c/12 h |
| Sinusitis aguda24,25,55 | Adultos: 5 díasNiños: 10 días | Amoxicilina 500-1.000mg c/8 h (*amoxicilina-clavulánico 500 mg/125mg c/8 h o 875 mg/125mg c/12 h)Amoxicilina 80-90 mg/kg/día en 2-3 tomas (* + clavulánico 10 mg/kg/día en 2-3 tomas) |
| Otitis media aguda26,55 | Adultos: 5-7 díasNiños > 2 años: 5-7 díasNiños < 2 años: 7-10 días | Amoxicilina 500-1.000mg c/8 h (*amoxicilina-clavulánico 500-875/125mg c/8 h)Amoxicilina 80-90 mg/kg/día en 2-3 tomas(* + clavulánico 10 mg/kg/día en 2-3 tomas, en niños < 6 meses) |
| Exacerbación de la EPOC30 | Sin riesgo de Pseudomonas aeruginosa: 5 díasRiesgo de P. aeruginosa: 10-14 días | Amoxicilina-clavulánico 875/125mg c/8 hCiprofloxacino 500-750mg c/12 h o levofloxacino 500mg c/12 h |
| Neumonía de la comunidad55 | 5 días | Amoxicilina 1.000mg c/8 h o amoxicilina-clavulánico 875/125mg c/8 h (en función de la edad y presencia de comorbilidades) |
| Cistitis no complicada34 | 1-5 días** | Fosfomicina trometamol 3g (dosis única)Nitrofurantoína 100 mg/8 h (5 días) |
| Pielonefritis no complicada34 | 5-10 días** | Cefuroxima axetil 500mg c/8-12 h (7 días) |
| Celulitis43,44,55 | 5 días | Cefadroxilo 500-1.000mg c/8-12 hAmoxicilina-clavulánico 875/125mg c/8-12 h |
Se debe tener en cuenta que, según la evidencia actual, hay situaciones en las que los tratamientos cortos pueden no ser adecuados: pacientes con inmunosupresión grave, infecciones graves o producidas por bacterias multirresistentes, control inadecuado del foco de la infección, pacientes con infección protésica, acceso inadecuado del antibiótico al lugar de la infección o en pacientes con una lenta evolución clínica6.
Traslado de la evidencia a la práctica clínicaLa duración del tratamiento antibiótico es uno de los aspectos que determina su idoneidad. A pesar de la evidencia disponible y de la inclusión en las guías, la aplicación en la práctica clínica de tratamientos antibióticos reducidos sigue siendo un desafío. Se han identificado diversas causas que no favorecen la implantación de las duraciones más cortas, entre las que se encuentran: a) la creencia de que la prolongación de la terapia es más segura y actúa en contra de la aparición de resistencias20,45; b) la falta de formación para la promoción y seguimiento del uso de terapias más cortas46; c) la falta de conocimiento de las guías, sensación de que no se ajustan al cuidado individualizado del paciente y escepticismo respecto a algunas recomendaciones de las mismas47; d) el desconocimiento de los pacientes respecto a los antibióticos, y e) el miedo de los prescriptores a ser culpado de los malos resultados clínicos48. Curiosamente, un estudio retrospectivo de cohortes mostró que los médicos de familia con más años en el ejercicio de la profesión prescriben tratamientos más largos, con la probable explicación de que se formaron en un momento en el que no había evidencia de tratamientos cortos y no se pensaba en el acuciante problema de las resistencias como una prioridad49.
Existen diversas estrategias para promover duraciones de tratamiento efectivo lo más cortas posible. Se recomienda que la duración se especifique en las guías y/o protocolos utilizados en nuestro entorno y es imprescindible incluir su abordaje en las actividades formativas50. Se ha identificado que la recomendación de un rango de días (p. ej., 5-7 días), en lugar de la duración más baja posible correspondiente (5 días en este caso), favorece la elección por el prescriptor de un número intermedio o el mayor número del rango, lo que conlleva duraciones más largas51.
Es imprescindible abordar la optimización de las duraciones de los tratamientos antibióticos en las actividades e intervenciones formativas, las cuales deben ir asociadas a asesorías/auditorías con feedback para aumentar su efectividad50. A nivel de la atención primaria es importante que la formación se dirija no solo a los médicos prescriptores, sino también a los pacientes, para poder trabajar con ellos de manera conjunta el conocimiento de la acción de los antibióticos y de la importancia de limitar su uso al estrictamente necesario45.
A diferencia del ámbito hospitalario, a nivel de la atención primaria se dificulta el seguimiento de la duración de los tratamientos. De hecho, el Plan Nacional frente a la Resistencia a los Antibióticos (PRAN) incluye indicadores de consumo de antibióticos a nivel de la atención primaria, pero no incluye indicadores relacionados específicamente con la duración del tratamiento52. No obstante, una de las propuestas del PRAN 2019-2021 es revisar el formato actual de los envases de los antibióticos y fomentar el uso de los formatos que se adecúen a la duración mínima recomendada de tratamiento1.
Sería interesante disponer de programas automatizados de soporte a la decisión clínica, integrados en las estaciones de trabajo, que propusieran automáticamente la duración recomendada en función de la indicación y las características del paciente50. También, como mejora en la calidad de la prescripción, se recomienda dejar constancia en la historia clínica del paciente de la indicación y duración prevista del tratamiento53.
¿Hacia dónde vamos?La duración óptima de los tratamientos debería plantearse de manera individualizada en función de la evolución clínica del paciente, y no como un rango fijo y estricto de duración, aunque este enfoque se dificulte a nivel de atención primaria45. En los próximos años veremos aumentar la evidencia respecto a la duración del tratamiento antibiótico de diferentes infecciones, con diseños de estudios pensados específicamente para establecer la duración óptima en función de la respuesta del paciente16,54.